HyMAX™Hybridoma Fusion & Cloning Supplement 20x
货号: 113004
规格: 100mL
产品描述:
HyMAX™杂交瘤融合与克隆补充剂20x
货号: 113004
替代名称:杂交瘤补充剂,杂交瘤克隆因子,HCF,杂交瘤克隆补充物,HCS,杂交瘤克隆融合补体,HCFS,杂交瘤生长补充剂,HGS,杂交瘤融合和克隆加强,杂交瘤融合和克隆补充,HFCS,细胞培养杂交瘤媒介补充
说明:HyMax™杂交瘤融合和生长补充剂是含有各种细胞因子,生长因子和激素的条件培养基的专有混合物。在新的杂交瘤发育过程中配制成替代饲养细胞。它也可用于从液氮快速回收冷冻细胞。
融合后细胞电镀期间常规使用饲养细胞。通常,饲养细胞为新开发的克隆提供许多未知的生长因子。这些包括许多涉及同种型转换和B细胞IgG分泌维持的细胞因子。从我们多年的杂交瘤发展经验,我们已经配制了这种有条件的媒体,支持更好的生长和更高频率的IgG生产克隆开发。测试杂交瘤集落形成效率和IgG分泌的维持。
用法:加入5mL HyMax™20x至95mL您目前用于培养细胞的工作介质,使其占5%。不要使用超过10%的HyMax™。继续用这种培养基培养细胞,直到细胞生长好几代。一旦细胞生长良好,通过逐步将百分比逐步降低到1%,0.5%和0%,可以将培养物从HyMax隔离。
格式:作为无菌过滤的组织培养物测试,20x浓缩液准备使用溶液。运送到客户之前切勿冻结。每个100mL瓶子足以制作2L工作介质,足以完成一个完整的杂交瘤开发项目。
储存:建议在4°C至8°C的冰箱中储存,直至6个月内使用。它可以制成等分试样,并在-20°C – 80°C下冷冻保存,长期在12个月内使用。避免反复冻融,这可能会导致活动减少或降水。
稳定性:储存于冰箱中的4°C至8°C或冷冻储存12个月时6个月。一旦在30天内解冻使用,或根据需要进行等分和储存。不要重复冻结和解冻。
运送:准备新鲜(30天内),并以蓝色冰袋液体形式运送。
HyMax与其他产品的第三方独立比较:
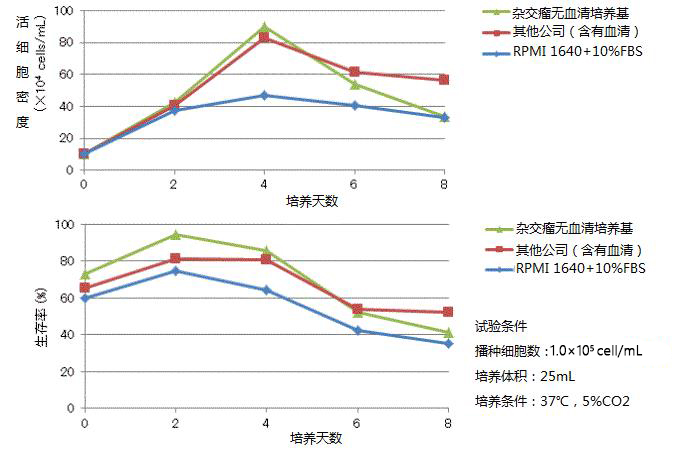
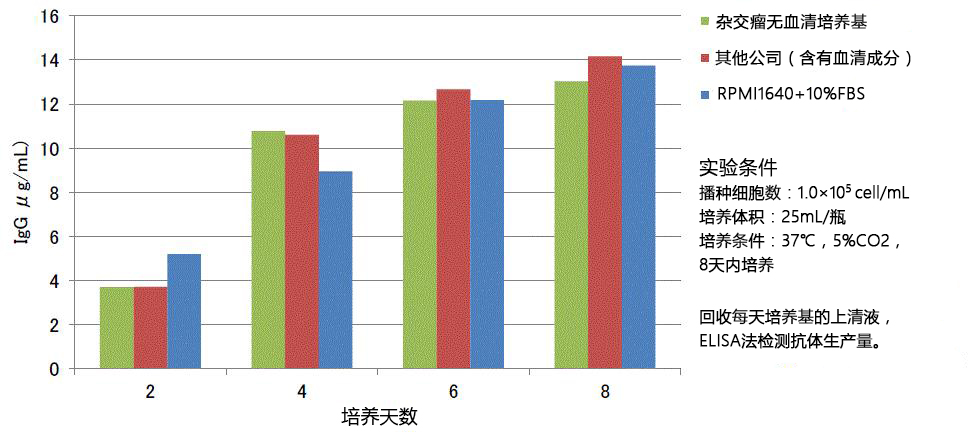
图-1用于产生IgG产生B细胞杂交瘤的克隆因子补充物的分析。脾细胞与SP2 / 0细胞融合,培养14天,然后分析来自培养物的上清液。通过抗Fc(γ)ELISA进行分析。IgG阳性克隆被鉴定为产生超过25ng / mL IgG的那些。
特点
- 无血清生长添加剂
- 低蛋白含量
- 成分*已知
- zui高克隆效率
- 优良的单克隆抗体生产
- 无需喂养细胞
|
品名 |
货号 |
规格 |
品牌 |
|
Hybridoma Fusion and Cloning Supplement; (HFCS) |
11363735001 |
10 ml (50x) |
Roche Applied Science |
Roche Applied Science品牌的 11363735001 已停产
|
品名 |
货号 |
规格 |
品牌 |
|
HyMAX™Hybridoma Fusion & Cloning Supplement 20x |
113004 |
100mL |
antibodyresearch |
HyMAX™ Hybridoma Fusion and Cloning Supplement, 20X
Catalog No.: 113004
Alternate Names: Hybridoma supplement, Hybridoma cloning factor, HCF, hybridoma cloning supplement, HCS, hybridoma cloning fusion supplement, HCFS, hybridoma growth supplement, HGS, hybridoma fusion and cloning booster, hybridoma fusion and cloning supplement, HFCS, Cell Culture Hybridoma Media Supplements
Description: HyMax™ Hybridoma Fusion and Growth Supplement is a proprietary blend of conditioned media containing various cytokines, growth factors & hormones. It is formulated to replace feeder cells during new hybridoma development. It can also be used for fast recovery of frozen cells from liquid nitrogen.
Feeder cells are routinely used during plating of cells after fusion. Typically feeder cells provide many unknown growth factors to the newly developing clones. These includes many cytokines which are involved in isotype switching and maintenance of IgG secretion by B-cells. From our many years of experience with hybridoma development we have formulated this conditioned media that support better growth & higher frequency of IgG producing clone development. It is tested for hybridoma colony forming efficiency and maintenance of IgG secretion.
Usage: Add 5mL of HyMax™ 20x to 95mL of your working media currently used for culturing cells to make 5%. Do not use HyMax™ at more than 10%. Continue with culturing cells with this media until cells have grown well for few generations. Once cells have grown well, culture may be weaned off of HyMax by gradually reducing the percentage in steps to 1%, 0.5% and 0%.
Format: Provided as a sterile filtered, tissue culture tested, 20x concentrate ready to use solution. Never frozen before shipping to customer. Each 100mL bottle is enough to make 2L of working media, enough for doing a complete hybridoma development project.
Storage: It is recommended to store at 4°C – 8°C in refrigerator until use within 6 months. It can be made into aliquots and frozen stored at -20°C – 80°C for long term to use within a 12 month period. Avoid repeated freezing and thawing, which may cause activity loss and or show precipitation.
Stability: 6 months when stored at 4°C – 8°C in refrigerator or 12 months when stored frozen. Once thawed use within 30 days or aliquot and store as needed. Do not freeze & thaw repeatedly.
Shipping: It is prepared fresh (within 30 days) and shipped in liquid form on blue ice packs.
Third party independent comparisons of HyMax to other products:
Figure-1 Analysis of cloning factor supplements for production of IgG-producing B cell hybridomas. Splenocytes were fused with SP2/0 cells, cultured for 14 days before analysis of supernatant from the cultures. Analysis was performed via anti-Fc (gamma) ELISA. IgG positive clones were identified as those producing more than 25ng/mL IgG.
我们公司zui大优势是强大的采购,
1:基本什么都能进口,血清,抗体,耗材,还有部分限制进口的,
2:货品全,现经营过700多个品牌,基本所有生物试剂耗材都可以进口,特别是冷偏的产品那就更有优势,
3:提供加急服务,一般1-2周到货,超过时限加急费全免
4:价格公道,绝大部分价格有优势,当然不能保证100%产品都是,因为意味着没有服务.
5:良好的信誉,大部分客户我们提供货到付款服务,客户包括清华,北大 交大 复旦,中山等100多所大学,ROCHE,阿斯利康,国药 ,fisher等500多家公司
6:我们*代理的品牌有:Antibody Research Corporation,arcticzymes,Biorelevant,AmberGen, Inc. ,clemente-associates,clodronaiposomes,Columbia Biosciences,enzyme research,Gene Bridges GmbH,Genovis,AmberGen, Inc. Biotechnology GmbH,Haematologic Technologies HTI Haemtech,hookelabs,Immudex,Innovative Research of America,inspiralis ,List Biological Laboratories, Inc.,lumafluor,Microsurfaces,multiplicom,nanotools,Pel-Freez Biologicals,pentapharm,progen,Protein Ark,QA-Bio,Inc,QA-Bio,IncQuickZyme Biosciences,Teknova,TriLink BioTechnologies, Inc.,Zyagen Laboratories 等
7:我们还是invitrogen,qiagen,Midland BioProducts Corporationam,sigma;neb,roche,merck, rnd,BD, GE,pierce,BioLegend等知名*批发,欢迎合作。